A MannKind Corporation receberá um pagamento inicial de 150 milhões de dólares e depois pagamentos parciais que podem chegar a 775 milhões de dólares, "caso sejam alcançados os objetivos particulares em termos de desenvolvimento, regulamentação e vendas". Caso todos os pagamentos sejam efetuados, o acordo pode alcançar 925 milhões de dólares.
Sanofi e MannKind, unidos no desenvolvimento e comercialização do Afrezza, compartilharão tanto as perdas como os lucros, com 65% e 35% de participação, respectivamente. O grupo farmacêutico também aceitou antecipar a Mannkind no máximo 175 milhões de dólares por sua participação nos gastos.
O acordo de colaboração prevê que a Sanofi assuma a responsabilidade do desenvolvimento, regulamentação e comercialização do produto. Em virtude de outro acordo, a MannKind produzirá o Afrezza em sua unidade de Danbury, Connecticut (nordeste dos Estados Unidos). Com o aumento de casos de diabetes registrados nos últimos anos, os grandes grupos farmacêuticos trabalham com formas de administração alternativas à injeção intravenosa subcutânea e às bombas de infusão de insulina.
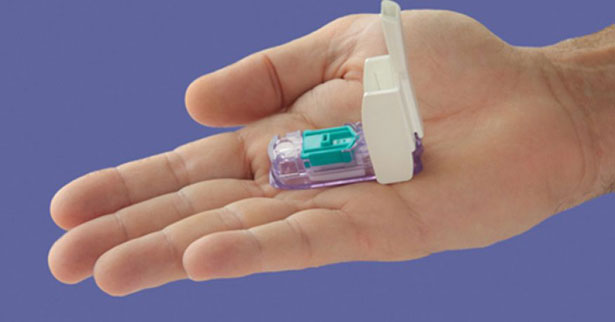
Com o formato de um apito, o Afrezza é utilizado antes das refeições. O medicamento não pode ser usado por pacientes com doenças respiratórias crônicas como asma. De acordo com a Sociedade Brasileira de Diabetes (SBD), o produto seria equivalente às insulinas de ação ultrarrápidas existentes no mercado, como a Humalog, Apidra ou Novorapid; só que administrada via inalatória.
A ação começa após 15 minutos da inalação do pó e tem pico depois de cerca de 50 minutos. O efeito acaba completamente em cerca de 2 horas e meia. Ou seja, o novo produto não substitui os tratamentos que utilizam insulina com ação lenta e prolongada.
O uso deve ser avaliado caso a caso. Alguns pacientes fazem uso de insulina de ação rápida antes das refeições, mas não podem deixar de aplicar a outra modalidade do hormônio à noite, antes de dormir, por exemplo. "Como acaba de ser aprovada no mercado americano e ainda não foi sequer aprovada no Brasil, a segurança em longo prazo é incerta na prática clínica diária", explica Carlos Eduardo Barra Couri, doutor em Endocrinologia pela Faculdade de Medicina de Ribeirão Preto (USP).
Exubera
Com informações da AFP