saiba mais
O grupo responsável pela pesquisa, formado por chineses e norte-americanos, conseguiu produzir imagens de altíssima resolução do exato momento em que esse receptor manifesta o seu "código de acesso" na membrana celular, permitindo a aproximação do vírus. O trabalho é um marco e deverá resultar no desenvolvimento de uma nova linha terapêutica contra a doença, ao interditar mais essa porta de entrada.
Laboratório
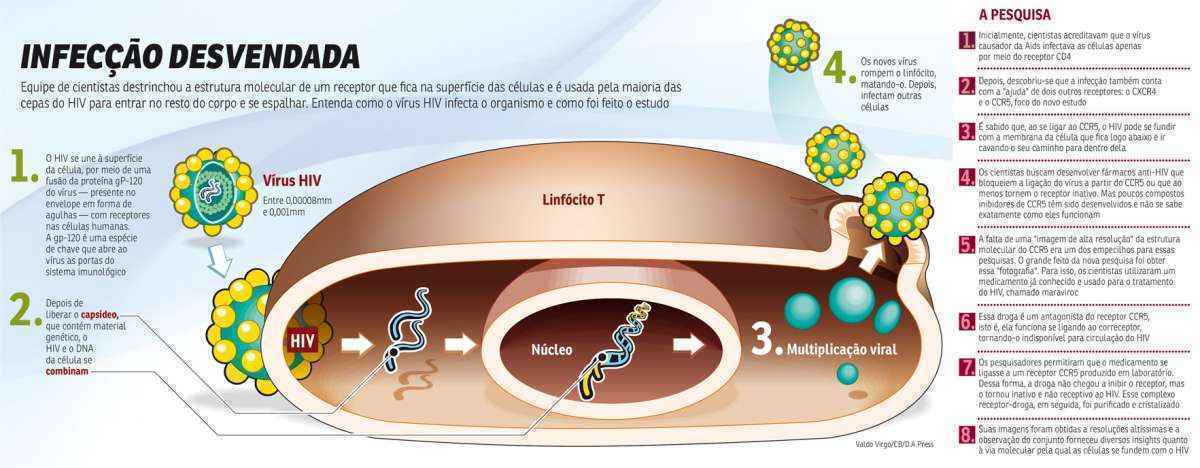
Na descoberta, publicada na edição de hoje da revista Science, os pesquisadores utilizaram um medicamento já conhecido na clínica médica para o tratamento do HIV, chamado maraviroc, para entender como ocorre o trabalho do CCR5. A escolha da droga se baseou na sua forma de funcionamento. Ela se liga ao correceptor com o objetivo de torná-lo indisponível para a ligação com o HIV.
Em laboratório, a equipe produziu um receptor CCR5 artificial por bioengenharia e permitiu que a droga realizasse essa ligação – o receptor foi purificado e cristalizado, resultando em imagens de altíssima resolução para que os cientistas pudessem observar bem de perto como funciona a ligação. Vale lembrar que o medicamento não proporcionou a inibição de receptor que continua a funcionar normalmente. No entanto, com a ligação ao maraviroc, ele se torna inativo e, no caso, insensível ao HIV. A observação desse complexo trouxe à tona uma série de peculiaridades moleculares que pode permitir, por exemplo, a alguns mutantes de HIV escapar dos inibidores de CCR5. Os cientistas sugerem que isso pode ocorrer quando o correceptor CCR5 assume uma estranha forma de cúpula que reduz a sua afinidade para inibidores, como o maraviroc, deixando o receptor livre e disponível para se ligar ao HIV.

Caminho árduo
Hoje, inúmeros estudos buscam compreender os mecanismos moleculares da entrada do HIV. Foi com esses trabalhos que se chegou à determinação do complexo estrutural de ligação gp120-CD4. Mas as relações de função e estrutura dos outros dois receptores permaneciam pouco compreendidas. Isso porque tanto o CCR5 quanto o CXCR4 pertencem a uma família proteica da membrana celular chamada de receptores acoplados à proteína G (GPCRs, em inglês). Estudos estruturais dessas moléculas são extremamente desafiadores pelo tamanho dessa superfamília, com 826 membros – o que a torna o maior conjunto proteico no genoma humano e alvo de mais de 40% de todas as drogas.
Stevens imagina que, no ritmo atual de pesquisa, ainda serão necessárias várias décadas para compreendê-la totalmente. “Isso é lamentável, já que entender como esses receptores trabalham e desenvolvem novas terapias pode levar a classes de medicamentos mais seguros para o tratamento de muitas e diferentes doenças humanas”, avalia o especialista.
Os estudos em busca da estrutura molecular dos correceptores para o HIV foram iniciados há seis anos, quando a principal autora do trabalho, Beili Wu, hoje professora do Laboratório de Pesquisa em Receptores da Academia Chinesa de Ciências, trabalhava como estudante de pós-doutorado no laboratório de Stevens. “Nosso objetivo era aprofundar a compreensão dos mecanismos moleculares de entrada do vírus HIV, resolvendo as estruturas cristalinas dos dois correceptores”, diz Wu.
Com o apoio de Stevens, em 2010, a equipe foi capaz de resolver cinco estruturas cristalinas independentes de complexos humanos com CXCR4. No ano seguinte, Wu voltou à China e construiu seu próprio grupo de pesquisa na Academia Chinesa de Ciências, em Xangai. Lá, seu time de cientistas se concentrou no CCR5. "Uma vez que apenas um número limitado de inibidores de CCR5 tenha sido desenvolvido, os estudos estruturais do receptor são particularmente difíceis", diz Wu, acrescentando que o trabalho anterior com o CXCR4 foi crucial para o sucesso do estudo mais recente.

Nova luz
“Os autores resolveram a estrutura para o complexo formado pelo inibidor de entrada do HIV-1, o maraviroc, e uma forma CCR5 bioengenhada, que é estabilizada por várias modificações. O maraviroc é um inibidor alostérico: seu local de ligação não é o mesmo das moléculas capazes de bloquear o funcionamento do receptor, isto é, ele atua indiretamente, alterando a forma geral do receptor. A estrutura do CCR5 revelada pelo trabalho lança luz mecanicista sobre a seletividade do correceptor para HIV-1. O novo conhecimento estrutural prepara o palco para o projeto racional de pequenas moléculas melhoradas inibidoras de CCR5 para a entrada do HIV. O conhecimento estrutural desses patógenos poderá, assim, nos ajudar a domá-los e impedir a sua união com a membrana celular."
Per Johan Klasse, Pesquisador da Universidade de Cornell